本报告对全球肿瘤学研发管线的特征和趋势进行了分析概述,并详细介绍了肿瘤学临床开发的未来趋势。
新治疗模式加速增长,PD-1/PD-L1热度降低
2022年启动的肿瘤学临床试验数目仍然维持在历史最高点,与2017年相比增加29%。其中57%的临床试验针对实体瘤,56%的临床试验针对罕见肿瘤。
l大多数肿瘤学试验都集中在罕见癌症上,56% 的试验在 2022 年开始评估罕见癌症的药物,但是罕见肿瘤学试验在 2021 年猛增 25% 之后在 2022 年下降了 6%。
l2022 年开始的肿瘤学中有 75% 正在测试针对实体瘤的药物,2022 年的增长与 2021 年持平。
l尽管一小部分试验涉及血液系统癌症,但从 2017 年到 2022 年,试验数量增加了 30%,2022 年开始有超过 550 项研究血液系统癌症治疗药物的试验。
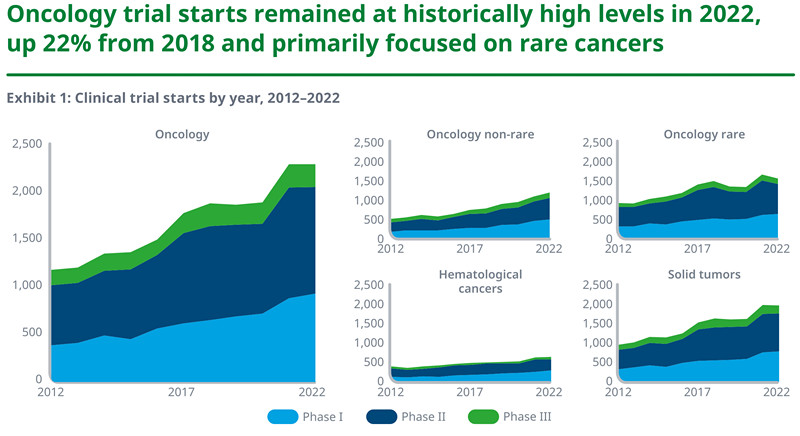
资料来源:IQVIA官网,湘医投整理
中国药企研发迅速增长
目前,世界各地有1000多家公司和近50个学术或研究团体参与了肿瘤学的研究。
l过去15年里,美国在肿瘤学领域的份额下降了5%,但仍保持在40%以上。
l欧洲的份额从五年前的26%下降到2022年的21%,而活跃的肿瘤学项目的绝对数量增长了19%,从458个增加到546个。
l总部设在日本的公司,肿瘤学研究项目的份额下降,从五年前的9%下降到2022年的5%。
l总部位于中国的公司的产品现在占肿瘤学研发项目的23%,高于五年前的10%和2007年的3%,并于2022年首次超过欧洲。
l尽管在过去五年中,活跃项目的绝对数量增长了82%,但韩国在肿瘤学研发项目中的份额一直较低且相对稳定。
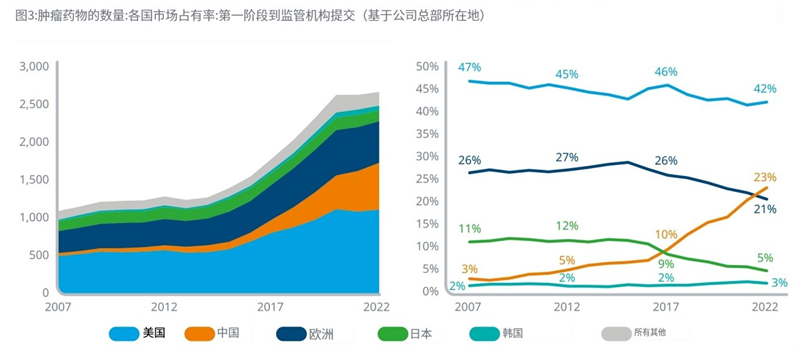
资料来源:IQVIA官网,湘医投整理
靶向疗法仍为研发热点,新一代生物疗法的增长迅猛。
l包括PD-1/PD-L1检查点抑制剂在内的免疫肿瘤学药物在过去十年中出现了显著增长,但近年来开始逐渐减少,从2018年开始下降,显示目前市场拥挤,研发正在转向更新的靶向分子。
l用于癌症治疗的双特异性抗体的开发显著增长,目前占血液系统癌症和实体肿瘤管道的7%,表明人们越来越关注这些分子作用于多个靶点或通过不同作用机制的能力。
l抗体-药物结合物允许将细胞毒剂直接靶向癌细胞,降低了旧化疗药物的非特异性,主要集中在实体肿瘤上,在过去五年中实体肿瘤的发展增长了65%。
l下一代生物疗法越来越多的被用于血液病癌症的研究,目前正在积极研究的产品数量是2017年的四倍多,占血液病癌症产品线的28%。
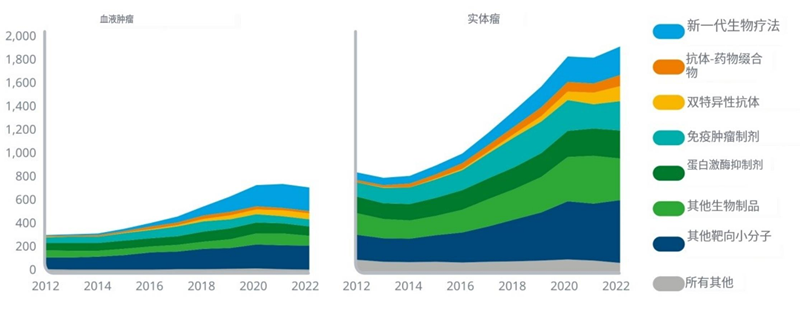
资料来源:IQVIA官网,湘医投整理
PD-1/PD-L1抑制剂试验增长迅速
lFDA于2014年批准了第一种PD-1/PD-L1检查点抑制剂pembrolizumab(Keytruda),用于黑色素瘤患者,自那以来,又有六种PD-1/PD-L1抑制剂被批准用于一系列血液病和实体瘤。
l2022年,1236项全球试验开始测试PD-1/PD-L1抑制剂,较2021年下降11%,但较2017年开始的804项增加54%。
l在2022年进行的3,000多项PD-1/PD-L1后期试验中,81%是仅在单个国家中进行临床试验。
l中国有1,287个正在进行的晚期PD-1/PD-L1试验,这些试验仅在国内进行,这些进行临床试验的药物将不会销往国际市场。
l超过80%的PD-1/PD-L1抑制剂临床试验正在调查其与其他药物的联合使用情况,PD-1/PD-L1抑制剂与针对近300个不同靶点和途径的疗法一起进行测试。
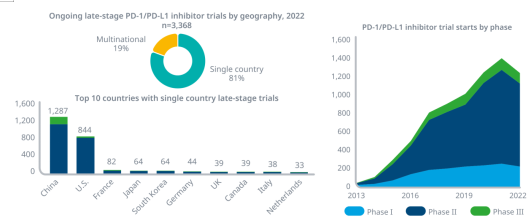
资料来源:IQVIA官网,湘医投整理
l首个批准用于癌症的抗体药物结合物吉图单抗奥佐米辛(Mylotarg)于2000年获得加速批准,但后来由于严重的安全问题退出市场,并于2017年再次获得批准。在2000年首次获批之后,目前已有15款获批新药靶向12个靶点,研发管线中在研ADC的靶点更为广泛(76个),其中HER2(28个在研项目),CLDN18(14)和Trop-2(12)是实体瘤在研ADC的常见靶点。
l尽管已停止的研究遇到了挫折,但仍有76个生物标志物靶点正在进行抗体-药物偶联物研究,其中28种产品目前正在开发中,靶向HER2,14种针对CLDN18,12种针对Trop-2,这是在实体瘤上表达的常见抗原。
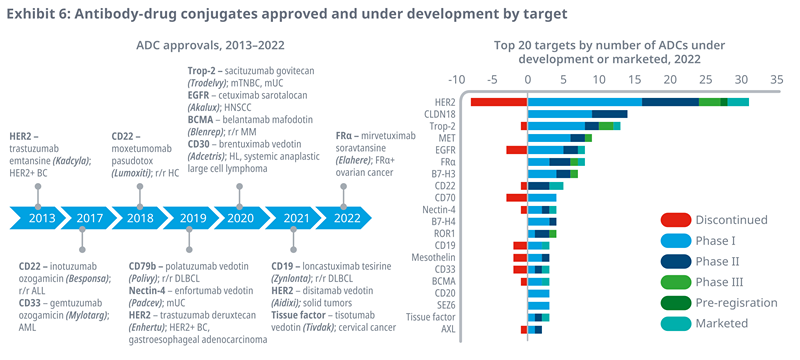
资料来源:IQVIA官网,湘医投整理
不断开发双特异性抗体,多种治疗模式踊跃出现
l双特异性抗体可以结合多个靶点,并通过将免疫细胞带入癌细胞或通过抑制或激活两个不同的靶点来发挥作用。
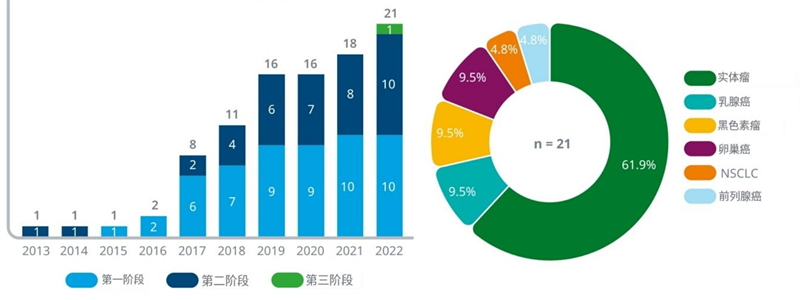
l目前市场上有六种双特异性抗体用于治疗癌症--三种用于血液病,三种用于实体瘤--包括双特异性T细胞结合蛋白(BITES)、博纳吐单抗(Blinatumomab)和Kimmtrak® (tebentafusp)。
l目前正在开发130多种用于癌症治疗的双特异性抗体,其中67%用于治疗实体瘤癌症,24%用于血液病癌症,近9%用于这两种癌症的研究。
l超过50%的双特异性抗体处于早期临床开发阶段,目前只有7%的双特异性抗体正在进行血液系统癌症的研究,5%的实体肿瘤抗体目前处于第三阶段试验。
l正在对一系列癌症进行双特异性抗体测试,多发性骨髓瘤和非霍奇金淋巴瘤在血液病、非小细胞肺癌和食道癌这些适应症有着显著进展,关于实体肿瘤中的一些药物正在开发中。
l随着双特异性抗体的开发取得进展,出现了新的多特异性抗体模式,如三特异性抗体。
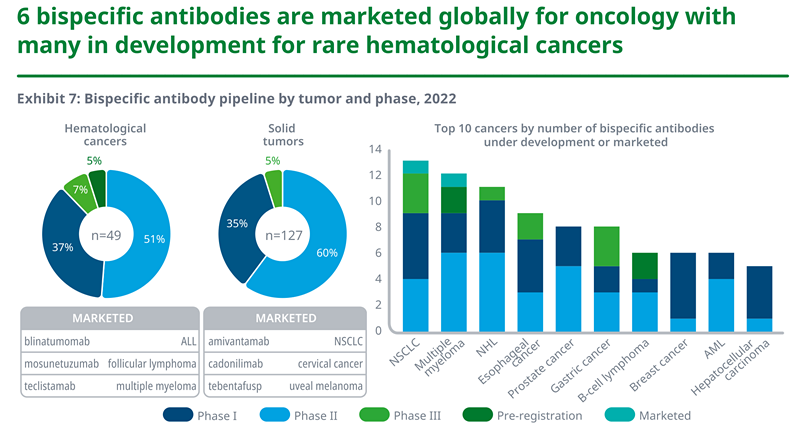
资料来源:IQVIA官网,湘医投整理
下一代生物治疗方法-细胞疗法,关注血液肿瘤的CAR T
l到 2022 年,有 194 种下一代生物治疗药物正在开发用于血液癌症,高于十年前的 14 种,用于实体瘤的有 254 种,高于十年前的 73 种。
l在所有治疗领域中,肿瘤学研究占下一代生物治疗管道的 42%,这突出表明大量研究和使用这些产品改善癌症患者护理的前景。
l嵌合抗原受体 (CAR) T 细胞和自然杀伤 (NK) 细胞疗法占下一代血液癌症生物治疗管道的 74%,并且越来越多地被用于实体瘤研究,许多胃癌 CAR T 疗法正在开发中、非小细胞肺癌和肝癌。
l自从用于预防 COVID-19 的 mRNA 疫苗快速开发和上市以来,长期以来在肿瘤学中进行研究的 RNA 和 DNA 疫苗受到了新的关注。
l包括 CRISPR 等基因编辑技术在内的基因疗法,过去在正在开发的肿瘤学下一代生物疗法中占有较大份额,但近年来由于临床试验中出现大量不良事件,研究速度放缓;然而,这导致了主动安全计划的实施,以确保在研究这些产品时患者的安全,认为基因疗法在未来仍然可能带来巨大的希望。
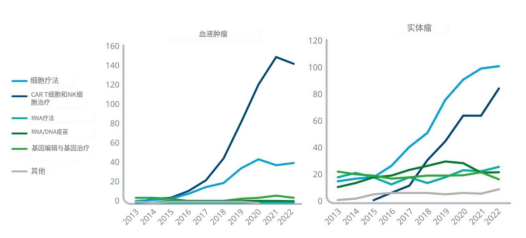
资料来源:IQVIA官网,湘医投整理
治疗实体瘤的CAR-T疗法比例正在上升
l第一个CAR T细胞疗法司利弗明(tisagenlecleucel)于2017年获批上市,用于治疗急性淋巴细胞白血病(ALL);自此之后,已经有六种 CAR-T 细胞疗法已在全球推出,用于治疗一系列复发或难治性血液癌症。
l2022年,有264项试验开始研究CAR T在肿瘤学中的使用,与2021年开始的数量相似,但实体瘤试验的启动数量增长了30%,而血液癌症试验的启动数量下降了11%。
l从历史上看,超过70%的试验是针对血液癌症的,但越来越多的CAR T试验正在研究实体瘤的治疗,占2022年开始试验的34%,高于2017年的22%。
l在2022年正在进行的852项CAR T 试验中,72%正在评估CAR T治疗血液癌症的效果,其中343项试验针对非霍奇金淋巴瘤患者。虽然仅占正在进行的试验的28%,但可以看出,针对实体瘤的CAR T细胞疗法正在研究一系列难以治疗的癌症,包括胃癌和胰腺癌。
l尽管98%的正在进行的试验只处于I期或II期,但目前在美国上市的所有CAR T都是根据I期或II期试验的数据获得批准上市。
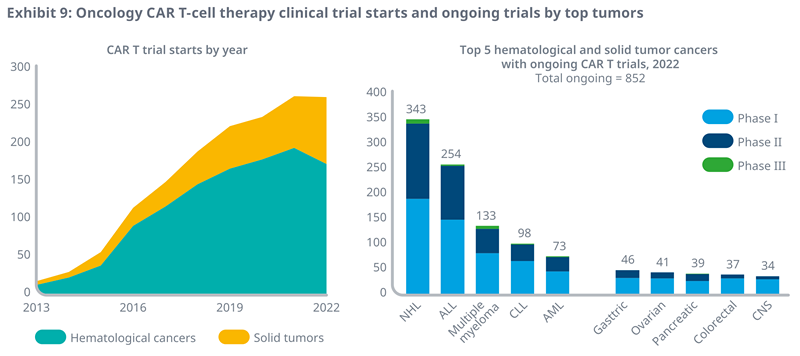
资料来源:IQVIA官网,湘医投整理
mRNA
lCOVID-19大流行增加了人们对mRNA疫苗的关注,但疫苗的开发速度很大程度上归功于数十年来对肿瘤学mRNA疫苗的研究。
l虽然在covid -19前mRNA疫苗管道中所占比例最大,但并没有大幅增加,到2022年仅占管道的8%。
l用于癌症治疗的mRNA疫苗的开发完全集中于治疗实体瘤,只有不到40%针对特定实体瘤适应症,大多数针对一系列晚期实体瘤。
l虽然mRNA疫苗正在单独测试用于治疗癌症,但许多疫苗也正在与免疫肿瘤学(如PD-1检查点抑制剂)结合进行测试,以增强人体对肿瘤的免疫反应。
l默克和Moderna最近宣布mRNA-4157联合pembrolizumab(一种PD-1检查点抑制剂)的II期阳性结果,与单独使用pembrolizumab相比,高风险黑色素瘤患者的复发或死亡风险降低了44%。
资料来源:IQVIA官网,湘医投整理
肿瘤学的临床成功率
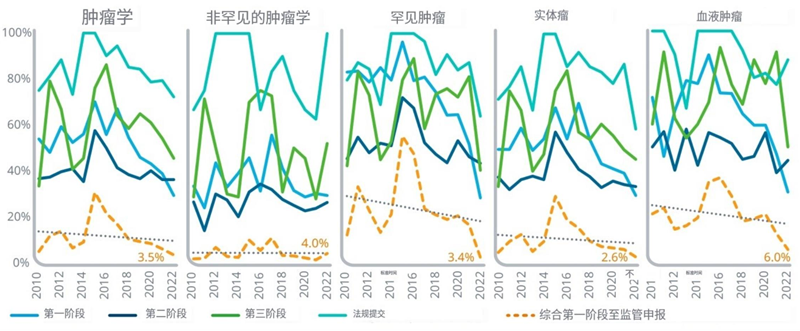
l2022年,肿瘤是所有治疗领域中综合成功率最低的领域之一,降至3.5%,自2015年以来呈下降趋势。
l肿瘤产品的成功率存在显著差异,自2010年以来,与非罕见癌症和实体瘤相比,针对罕见癌症和血液系统癌症的产品平均成功率更高。
l正在研究的罕见癌症药物在2022年的所有阶段的成功率都急剧下降,其中I期和III期成功率下降幅度最大,导致所有阶段的综合成功率从2021年的17%下降到2022年的3%。这凸显了罕见癌症药物进入市场的临床之旅更加艰难。
l正在研究的非罕见癌症药物面临着更高程度的不确定性,在所有阶段只有4.0%的成功率,由于增加和III期和监管成功,这一比例略高于往年,但仍然很低。
l针对血液癌症的药物往往比针对实体肿瘤的药物更成功,血液癌症药物进入市场的可能性是针对实体肿瘤的药物的两倍。
靶向治疗抗药性的新组
资料来源:IQVIA官网,湘医投整理
肿瘤中的新活性物质
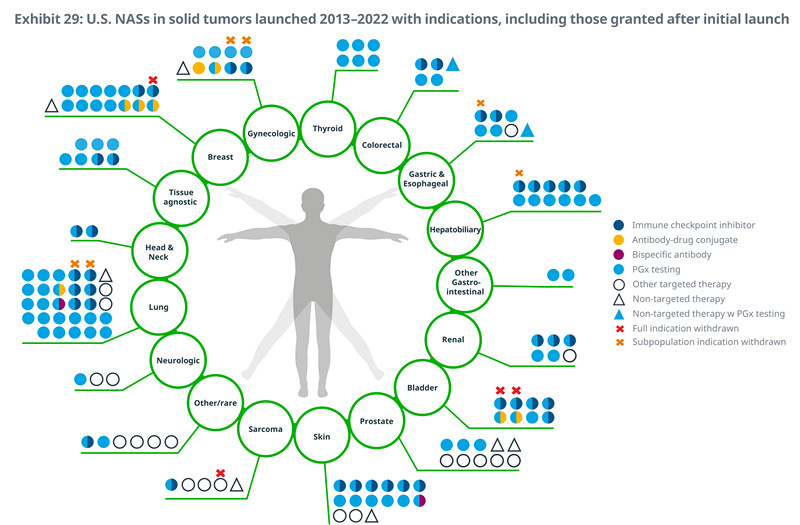
l自2013年以来,美国已经推出了89种治疗实体肿瘤的新型抗癌药物,其中22种药物自推出以来已被批准用于多种适应症。
l肺癌方面出现了重大创新,推出了29种产品,几乎所有针对各种生物标志物亚型的靶向治疗,包括8种检查点抑制剂(其中两种已被撤销,用于小细胞肺癌)、1种双特异性抗体和1种抗体-药物结合物。
l自2011年以来,乳腺癌已经推出了15种新药用于治疗,其中包括两种针对HER2阳性乳腺癌的抗体-药物结合物,以及一种针对三阴性乳腺癌的抗体-药物结合物。
l在过去十年里,已经推出了15种治疗皮肤癌的新药,其中12种用于治疗黑色素瘤。这包括六种检查点抑制物和一种双特异性抗体。
资料来源:IQVIA官网,湘医投整理
主要靶向疗法
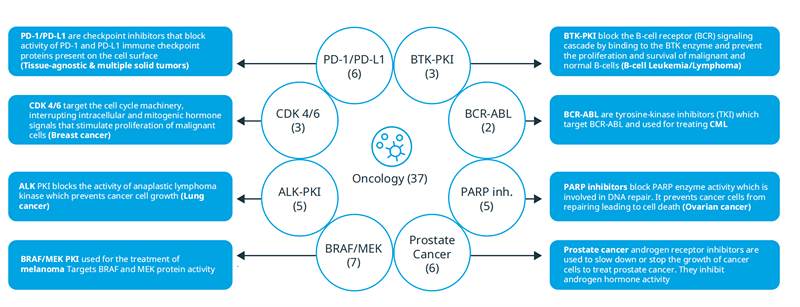
创新抗癌疗法的问世在过去10年里给患者带来了显著的临床获益并且获得了广泛的应用。总结了8大类给患者带来显著获益的创新疗法。其中包括PD-1/PD-L1抑制剂,以PARP抑制剂为代表的合成致死疗法,以及CDK4/6抑制剂,BTK抑制剂等多项靶向疗法。
资料来源:IQVIA官网,湘医投整理
非小细胞肺癌领域
在非小细胞肺癌领域,虽然转移性患者数目仍然在增多,但是2022年患者治疗方案(patient treatment regimens)的总数与2019年相比有所下降,这可能是因为创新疗法让更多患者获得缓解并且缓解持续时间延长。转移性NSCLC的治疗模式在过去3年中也产生了显著变化。PD-1/PD-L1单药治疗方案比例显著下降,基于PD-1/PD-L1的组合疗法比例上升,创新靶向疗法(比如新一代EGFR、ALK和KRAS抑制剂)的使用比例也显著上升。
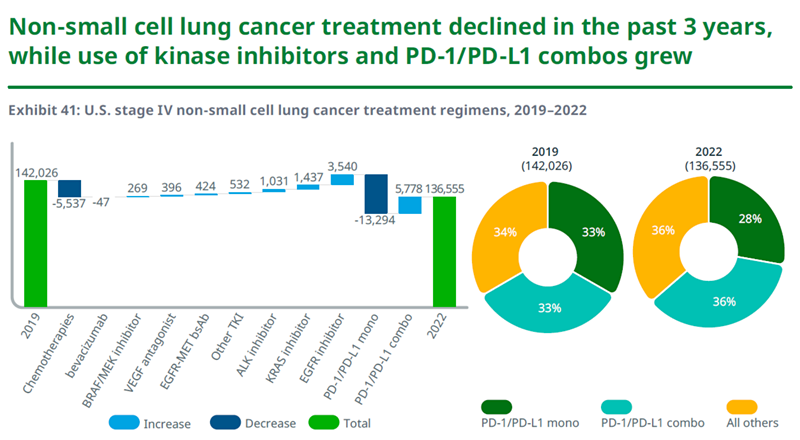
资料来源:IQVIA官网,湘医投整理
妇科癌症领域
在妇科癌症方面,免疫疗法和PARP抑制剂的问世改变了这些癌症的治疗模式。近年来越来越多的免疫疗法用于治疗三阴性乳腺癌、宫颈癌和子宫内膜癌。PARP抑制剂已经成为卵巢癌治疗的支柱之一。
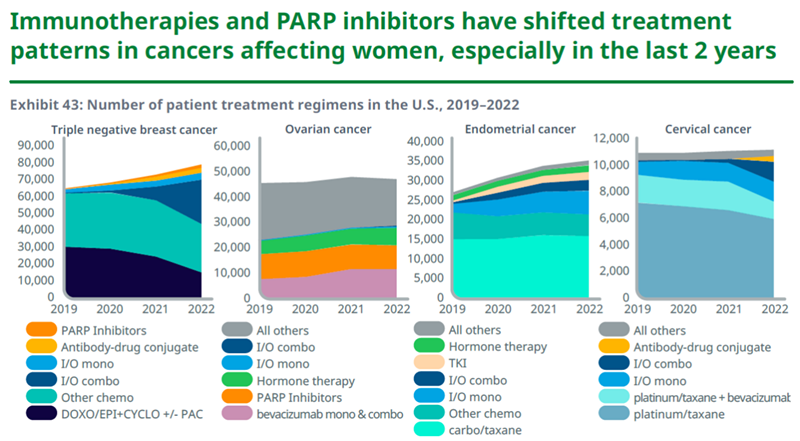
资料来源:IQVIA官网,湘医投整理
展望未来: 肿瘤学的主要研发趋势
新模式和新靶点
l正在设计广泛的多特异性抗体(例如 TrAb、四特异性抗体)管道,以通过将免疫细胞(例如 T 细胞和 NK 细胞)重定向至特定肿瘤抗原来增强抗肿瘤作用。虽然靶向多种抗原会导致针对肿瘤的显着免疫反应,但仍需要优化以克服体内耐久性和脱靶效应等挑战。
l正在探索非编码 RNA 作为潜在靶标(例如,肺癌和乳腺癌中的 piRNA)和指导风险分层的诊断标记(例如,在子宫内膜癌和肺癌中),一旦成为最佳药物,这可能会开启新的 RNA 相关治疗机会交付、耐受性和特异性得以实现。
新模式、靶向治疗及其在早期治疗上的应用
lADC、BsAbs和CAR-T在晚期疾病中取得了成功,预计将继续进入早期治疗(例如,CAR T批准用于2L DLBCL但CAR扩展到1L DLBCL)。
lPD-1/PD-L1抑制剂和靶向治疗也在转向更早的治疗方法(例如,可切除NSCLC的nivolumab+化疗;EGFR+佐剂NSCLC的osimertinib),预计将进入更早的系列成为SOC的额外免疫疗法。
l最近宣布的监管计划,如Project Foretrunner--一项旨在使药物在较早批次获得批准以帮助加快肿瘤学创新的倡议-预计将鼓励利益相关者(如药企)重新设想肿瘤学研发。
靶向治疗抗药性的新组合
l鉴于新的治疗方式最终跨越到更早的治疗阶段,预计将出现广泛的治疗耐药人群,并将需要创造性的治疗组合,为患者提供持久有效的治疗选择。迄今为止,在成功联合治疗方面的进展喜忧参半(例如,培溴利珠单抗+lenvatinib在黑色素瘤中的失败;pembrolizumab+mRNA-4157/V940在黑色素瘤中显示了成功的信号)。
超越 PD-1/PD-L1 的下一波靶点
l免疫检查点靶点,如LAG-3和TIM-3,已经在黑色素瘤和其他疾病中取得了积极的结果,为PD-1/PD-L1以外的免疫治疗的创新铺平了道路。这也将使潜在的与现有PD-1/PD-L1的联合疗法能够提供增强的免疫调节效果。
mRNA的临床研究进展
l新冠肺炎基因疫苗的成功加速了人们对基因疫苗靶向肿瘤的潜力的兴趣,使令人兴奋的组合研究(例如,BNT122+阿替唑单抗(PDAC),BNT111+cymplimab(黑色素瘤))有望进入后期临床试验。
CtDNA在临床护理中的整合应用
lCtDNA将越来越多地用于患者旅程的不同阶段,从早期疾病检测、靶向治疗识别、治疗期间的MRD评估到了解疾病的耐药机制。
l测序准确性的提高将确保ctDNA/MRD的多种使用,包括可能被用作临床试验的替代终点。
临床试验中MTD的优化
l目前对于探索剂量的优化,通常是在批准后,导致了会在在临床试验期间测试最大耐受剂量。这可能会导致不必要的毒性而没有临床益处,并使患者错过了延长时间接受有益治疗的机会。
l所以有必要进行管理,以获得对尽可能多的患者安全有效的最佳剂量治疗。FDA的Optimus项目是一项倡议,旨在让制造商在进行注册试验之前确定最佳剂量。
